Arsenicin A
Arsenicin A ist ein Naturstoff mit einer Adamantan-Struktur, der mehrere Arsen-Atome enthält.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
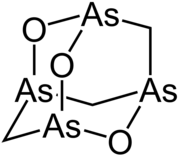
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Arsenicin A | ||||||||||||
| Andere Namen |
2,4,6-Trioxa-1,3,5,7-tetraarsatricyclo[3.3.1.13,7]decan (IUPAC) | ||||||||||||
| Summenformel | C3H6O3As4 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 389,76 g·mol−1 | ||||||||||||
| Schmelzpunkt |
182–184 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Arsenicin A wurde aus dem Schwamm Echinochalina bargibanti von der Küste Neukaledoniens extrahiert und war der erste bekannte Naturstoff mit mehreren Arsenatomen.[3]
Synthese
[Bearbeiten | Quelltext bearbeiten]
Eine Totalsynthese ausgehend von Methylenbis(phenylarsinsäure) wurde beschrieben. Diese wird zunächst mit Natriumborhydrid reduziert und dann mit Butyllithium und TMEDA in ein Lithiumorganyl überführt. Dieses reagiert mit zwei Molekülen (Chlormethyl)diphenylarsin zu einer offenkettigen Verbindung, die schon alle drei Kohlenstoffatome und vier Arsenatome enthält. Durch Reaktion mit wasserfreiem Iodwasserstoff werden die Phenylgruppen abgespalten und durch Iodatome ersetzt. Durch Reaktion mit wässrigem Ammoniak wird die Verbindung hydrolysiert und die Iodatome durch Hydroxygruppen ausgetauscht. Dieses Intermediat cyclisiert ohne weitere Syntheseschritte unter Abspaltung von drei Molekülen Wasser zum Arsenicin A.[4] Einige abgeleitete nicht natürliche Verbindungen wurden ebenfalls synthetisiert.[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Arsenicin A ist chiral und tritt in zwei unterschiedlichen Enantiomeren auf.[1] Dabei sind die Arsenatome die Stereozentren.[6]
Die Verbindung wirkt als Antibiotikum, zum Beispiel gegen Staphylococcus aureus, Escherichia coli und Candida albicans.[3] Es hat in Experimenten auch gegen mehrere Sorten von Krebszellen gewirkt.[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Di Lu, Michelle L. Coote, Junming Ho, Nathan L. Kilah, Ching-Yeh Lin, Geoff Salem, Michelle L. Weir, Anthony C. Willis, S. Bruce Wild, Pierre J. Dilda: Resolution and Improved Synthesis of (±)-Arsenicin A: A Natural Adamantane-Type Tetraarsenical Possessing Strong Anti-Acute Promelocytic Leukemia Cell Line Activity. In: Organometallics. Band 31, Nr. 5, 12. März 2012, S. 1808–1816, doi:10.1021/om201180d.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Ines Mancini, Graziano Guella, Maryvonne Frostin, Edouard Hnawia, Dominique Laurent, Cecile Debitus, Francesco Pietra: On the First Polyarsenic Organic Compound from Nature: Arsenicin A from the New Caledonian Marine SpongeEchinochalina bargibanti. In: Chemistry – A European Journal. Band 12, Nr. 35, 4. Dezember 2006, S. 8989–8994, doi:10.1002/chem.200600783.
- ↑ Di Lu, A. David Rae, Geoff Salem, Michelle L. Weir, Anthony C. Willis, S. Bruce Wild: Arsenicin A, A Natural Polyarsenical: Synthesis and Crystal Structure. In: Organometallics. Band 29, Nr. 1, 11. Januar 2010, S. 32–33, doi:10.1021/om900998q.
- ↑ Jacopo Vigna, Denise Sighel, Emanuele Filiberto Rosatti, Andrea Defant, Michael Pancher, Viktoryia Sidarovich, Alessandro Quattrone, Ines Mancini: Expanding the Chemical Space of Arsenicin A-C Related Polyarsenicals and Evaluation of Some Analogs as Inhibitors of Glioblastoma Stem Cell Growth. In: Marine Drugs. Band 21, Nr. 3, 17. März 2023, S. 186, doi:10.3390/md21030186, PMID 36976235, PMC 10051910 (freier Volltext).
- ↑ Di Lu, Sundaram Arulmozhiraja, Michelle L. Coote, A. David Rae, Geoff Salem, Anthony C. Willis, S. Bruce Wild, Shirine Benhenda, Valerie Lallemand Breitenbach, Hugues de Thé, Xiaoyi Zhai, Philip J. Hogg, Pierre J. Dilda: Sulfur Derivatives of the Natural Polyarsenical Arsenicin A: Biologically Active, Organometallic Arsenic–Sulfur Cages Related to the Minerals Realgar and Uzonite. In: Organometallics. Band 34, Nr. 5, 9. März 2015, S. 829–840, doi:10.1021/om500829y.