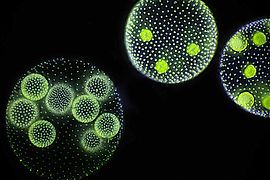
Volvox
| Volvox | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Volvox aureus | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Volvox | ||||||||||||
| L., 1758 |
Volvox oder auch Kugelalge (von lat. volvere: wälzen, rollen) ist eine Gattung mehrzelliger Grünalgen aus der Klasse der Chlorophyceae, die im Süßwasser leben. Die einzelnen Zellen von Volvox ähneln einzelligen Grünalgen, daher gilt Volvox als Organismus nahe der Schwelle von der Ein- zur Mehrzelligkeit. Volvox ist auch einer der einfachsten Organismen, bei denen der Tod zum normalen Lebenszyklus gehört, da die Mutterorganismen absterben, wenn sie die Tochterorganismen freisetzen. Dagegen können sich Einzeller in der Regel durch Zellteilung unendlich fortpflanzen.
Merkmale
[Bearbeiten | Quelltext bearbeiten]
1. chlamydomonasähnliche Zelle, 2. Tochterkugel, 3. Plasmabrücken, 4. Gallerte, 5. Fortpflanzungszelle, 6. Körperzelle
Volvox erscheint als Kugeln von 0,15 bis 1 Millimeter Durchmesser. Dabei bilden 500 bis 60.000 Zellen eine Hohlkugel aus einer einzelnen Schicht;[1] bei Volvox globator sind es bis zu 16.000 Zellen. Im Inneren der Kugel befindet sich eine farblose Gallerte. Bei einigen Arten sind die Zellen durch Cytoplasma-Stränge miteinander verbunden. Jede Einzelzelle hat zwei Geißeln, einen Augenfleck und einen Chloroplasten sowie zwei kontraktile Vakuolen, wodurch sie den Grünalgen Chlamydomonas gleichen.
Die Fortbewegung erfolgt unter Drehung um die Längsachse. Polarität ergibt sich durch Zelldifferenzierung: Im vorderen Bereich befinden sich nur somatische Zellen, als solche sind sie nicht an der Fortpflanzung beteiligt. Die somatischen Zellen dienen der Fortbewegung der Kugel, der Photosynthese und der Produktion der extrazellulären Matrix. Im hinteren Bereich befinden sich größere generative Zellen, die sogenannten Gonidien.
-
Volvox-Kugeln, Dunkelfeld-Aufnahme.
-
Volvox-Kugeln, Hellfeld-Aufnahme.
-
Rechts eine geplatzte Kugel, die Tochterkugeln entlässt. Hellfeld-Aufnahme.
-
Die gleiche Szene als Dunkelfeld-Aufnahme.
Vermehrung
[Bearbeiten | Quelltext bearbeiten]Ungeschlechtliche Fortpflanzung erfolgt, indem sich die einzelnen Gonidien, ohne Größenzunahme (Wachstum), synchron neun- bis zwölfmal teilen. Die Zellen sind immer durch Cytoplasma-Brücken verbunden, bilden also einen ungeteilten Zellverband (Syncytium).[2] Der so entstandene Embryo enthält bereits alle Zellen der künftigen Tochterkugel. Er bildet eine einschichtige Hohlkugel, die ins Innere der Mutter ragt. Dabei sind die Geißeln in das Innere der neuen Hohlkugel gerichtet. Damit ein funktionsfähiges Individuum entsteht, wird das Innere nach außen gestülpt (Inversion). Die Inversion ist ein komplexer Vorgang, von dem bei verschiedenen Volvox-Arten zwei Varianten bekannt sind. Beim Typ A wird in der Hohlkugel eine Öffnung (genannt Phialopore) gebildet. Die Wände der Kugel stülpen sich davon ausgehend kragenförmig nach außen und bilden ein schüsselförmiges, doppelschichtiges Stadium, bis sie sich auf der entgegengesetzten Seite erneut treffen. Anschließend wird die verbliebene Öffnung geschlossen. Beim Typ B beult sich die Kugel von einem Pol aus nach innen ein. Erst anschließend bildet sich außen an der eingedellten Kugeloberfläche eine Phialopore, von der aus die Wände in einer rollenden Bewegung zum entgegengesetzten Pol hin die Kugel erneut schließen. Für die Bewegungsvorgänge sind Änderungen der Form, teilweise auch des Volumens, der einzelnen Zellen wesentlich.[3]
Die Freisetzung der Tochterkugeln erfolgt erst nach dem Absterben der somatischen Zellen der Mutter.
Die geschlechtliche Fortpflanzung erfolgt durch Oogamie. Die Gonidien männlicher Organismen bilden durch Mehrfachteilung Spermatozoiden-Pakete. Diese erscheinen als gelbliche bis orange Zellplatten, bevor sie freigesetzt werden. Die weiblichen Organismen bilden unbegeißelte Eizellen. Nach der Befruchtung bildet sich aus der befruchteten Eizelle eine orange, an der Oberfläche ornamentierte Dauer-Zygote, die auch als Überdauerungsstadium unwirtliche Zeiten überstehen kann. Die Zygote keimt dann unter Reduktionsteilung und bildet ein neues Individuum. Es gibt jedoch auch einhäusige (monözische) Individuen, die männliche und weibliche Geschlechtszellen bilden.
Ökologie
[Bearbeiten | Quelltext bearbeiten]Die Gattung kommt in stehenden, bevorzugt in eutrophen, Gewässern vor. Insbesondere besitzen alle Arten einen sehr hohen Phosphatbedarf. Volvox-Arten sind meist Spezialisten in sehr flachen, meist austrocknenden (temporären) Flachgewässern wie Tümpeln und Lachen. Sie kommen auch in geschichteten (stratifizierten) Seen vor. Volvox-Arten sind besonders häufig im Frühjahr und Frühsommer, sie bilden hier einen eigenen Massenaspekt im Jahresgang eutropher Gewässer.[4][5] Gelegentlich können sie Algenblüten bilden.[6] Ungünstige oder Austrocknungsphasen überstehen sie durch die Bildung der dauerhaften Zygosporen.
Volvox kommt häufig in stark getrübten Gewässern vor, die entweder durch aufgewirbelten Schlamm oder durch die hohe Algenbiomasse unter eutrophen Bedingungen geringe Sichttiefe aufweisen. Hier kommt den Arten ihre hohe Beweglichkeit zugute, die es ihnen ermöglicht, immer in der belichteten (euphotischen) Zone zu verbleiben. Volvox ist dabei etwas schwerer als Wasser, würde also ohne aktive Bewegung zum Grund absinken. Die Kugeln können die Richtung zum Licht mit ihrem Augenfleck wahrnehmen. Außerdem ist das Hinterende der Hohlkugel etwas schwerer, so dass die Kugel tendenziell eher nach oben schwimmt. Viele Arten können tagesperiodische Wanderungen durchführen, bei denen sie nachts in tiefere Wasserschichten absinken und tagsüber in die belichtete Zone zurückschwimmen. Dabei können sie Strecken von mehreren Metern zurücklegen, was für Phytoplankton ungewöhnlich und eigentlich eher typisch für Zooplankton ist.[7] Als Grund für die Wanderungen wird Nährstoffaufnahme (vor allem Phosphat) im Tiefenwasser angenommen.
Systematik
[Bearbeiten | Quelltext bearbeiten]Volvox ist die namensgebende Gattung der Familie Volvocaceae. Die Gattung umfasst rund 20 Arten, von denen drei in Europa vorkommen:
- Volvox globator mit durchschnittlich 10.000 Einzelzellen. Die Individuen sind einhäusig, wobei die männlichen Geschlechtszellen zuerst reifen.[8]
- Volvox aureus mit 200 bis 3200 Einzelzellen, zweihäusig. Ausgeprägte tägliche Vertikalwanderung: tagsüber nahe der Oberfläche, nachts in tieferen Schichten.[8]
- Volvox tertius: Die erwachsenen Zellen sind nicht durch Plasmafäden verbunden.[8]
Mit den Methoden der molekularen Phylogenie, anhand des Vergleichs homologer DNA-Sequenzen, konnte klar nachgewiesen werden, dass die „Gattung“ Volvox polyphyletisch ist. Das bedeutet, dass einzelne der Gattung zugeordnete Arten näher mit Vertretern anderer Gattungen verwandt sind als untereinander.[9][10] Volvox aureus gehört demnach zu den Vertretern der Gattung Pleodorina, Volvox gigas gehört zur Gattung Eudorina, Volvox globator und einige verwandte Arten stehen Platydorina nahe. Eine engere Verwandtschaft wies nur die Artengruppe um Volvox carteri auf. Volvox im klassischen Sinne ist eher so etwas wie ein bestimmter Bauplantyp (Organisationsniveau), welches offensichtlich von Vertretern verschiedener Stammlinien unabhängig voneinander erreicht wurde. Während also die Typusgattung Volvox keine natürliche Einheit darstellt, wurde die Monophylie der Ordnung Volvocales, und auch ihr Schwestergruppenverhältnis zu Chlamydomonas reinhardtii, in den Analysen bestätigt.
Das komplette Genom von Volvox carteri ist im Jahr 2010 sequenziert worden.[11] Dabei erwies sich, dass das Genom eine vergleichbare Größe und eine vergleichbare Anzahl proteincodierender Gene aufweist wie dasjenige des schon eher sequenzierten einzelligen Verwandten Chlamydomonas reinhardtii. Für Volvox carteri werden etwa 14.500 Proteine vorhergesagt. Wesentliche Unterschiede zum einzelligen Verwandten zeigten sich in den Genen für die extrazelluläre Strukturmatrix und in Genen, die die Abfolge der Zellteilungen steuern.
Von Volvox liegen keine Fossilien vor, solche sind in Anbetracht seines Körperbaus auch nicht zu erwarten. Mit den Methoden der molekularen Uhr und anhand des Vergleichs mit fossilierten Schwestergruppen („Ghost lineage“-Kalibrierung) wird für die Evolution der Vielzelligkeit von Volvox eine Zeitspanne von etwa 234 Millionen Jahren (in der Trias) ermittelt.[12] Dies ist deutlich älter als frühere Schätzungen, die lediglich ca. 50 Millionen Jahre angenommen hatten.
Erforschung
[Bearbeiten | Quelltext bearbeiten]Die erste Beschreibung von Volvox liegt durch den berühmten holländischen Mikroskopie-Pionier Antoni van Leeuwenhoek vor, der sie (im Alter von etwa siebzig Jahren) im Jahr 1700 beschrieb.[5] Van Leeuwenhoek beschrieb bereits die charakteristische, rollende Bewegungsweise der Volvox-Kugeln im Wasser. Auch die „Geburt“ von Tochterkugeln durch die Wand einer Mutter wurde von ihm beobachtet.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Literatur
[Bearbeiten | Quelltext bearbeiten]- Karl-Heinz Otto Linne von Berg, Michael Melkonian u. a.: Der Kosmos-Algenführer. Die wichtigsten Süßwasseralgen im Mikroskop. Kosmos, Stuttgart 2004, ISBN 3-440-09719-6.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Peter H. Raven, Ray F. Evert und Susan E. Eichhorn: Biologie der Pflanzen. 4. Auflage. de Gruyter, Berlin 2006, ISBN 978-3-11-018531-7, S. 378.
- ↑ Harold J. Hoops, Ichiro Nishii, David L Kirk: Cytoplasmic Bridges in Volvox and Its Relatives. In: Madame Curie Bioscience Database [Internet]. Austin (Texas): Landes Bioscience; 2000-. Online.
- ↑ Stephanie Höhn & Armin Hallmann (2011): There is more than one way to turn a spherical cellular monolayer inside out: type B embryo inversion in Volvox globator. BMC Biology 2011, 9: 89. Online.
- ↑ C.S. Reynolds Phytoplankton periodicy: its motivation, mechanisms and manipulation. In: Fiftieth annual report for the year ended 31st March 1982. Ambleside, UK, Freshwater Biological Association, pp. 60–75.
- ↑ a b David L. Kirk: Volvox: A Search for the Molecular and Genetic Origins of Multicellularity and Cellular Differentiation. Cambridge University Press, 1998.
- ↑ Hans W. Paerl (1988): Nuisance phytoplankton blooms in coastal, estuarine, and inland waters. Limnology and Oceanography 33(4, part 2): 823–847.
- ↑ Ulrich Sommer & Z. Maciej Gliwicz (1986): Long range vertical migration of Volvox in tropical Lake Cahora Bassa (Mozambique). Limnology and Oceanography 31(3): 650–653.
- ↑ a b c Heinz Streble, Dieter Krauter: Das Leben im Wassertropfen. Mikroflora und Mikrofauna des Süßwassers. Ein Bestimmungsbuch. 10. Auflage. Kosmos, Stuttgart 2006, ISBN 3-440-10807-4, S. 164.
- ↑ H. Nozaki (2003): Origin and evolution of the genera Pleodorina and Volvox (Volvocales). Biologia (Bratislava) 58: 425–431.
- ↑ David L. Kirk (2005): A twelve-step program for evolving multicellularity and a division of labor. BioEssays 27 (3): 299–310.
- ↑ Simon E. Prochnik, James Umen, Aurora M. Nedelcu, Armin Hallmann, Stephen M. Miller, Ichiro Nishii, Patrick Ferris, Alan Kuo1, Therese Mitros, Lillian K. Fritz-Laylin, Uffe Hellsten, Jarrod Chapman, Oleg Simakov, Stefan A. Rensing, Astrid Terry, Jasmyn Pangilinan, Vladimir Kapitonov, Jerzy Jurka, Asaf Salamov, Harris Shapiro, Jeremy Schmutz, Jane Grimwood, Erika Lindquist, Susan Lucas, Igor V. Grigoriev, Rüdiger Schmitt, David Kirk, Daniel S. Rokhsar (2010): Genomic Analysis of Organismal Complexity in the Multicellular Green Alga Volvox carteri. Science 329(5988): 223–226. doi:10.1126/science.1188800
- ↑ Matthew D. Herron, Jeremiah D. Hackett, Frank O. Aylward, Richard E. Michod (2009): Triassic origin and early radiation of multicellular volvocine algae. Proceedings of the National Academy of Sciences USA Vol. 106 No. 9: 3254–3258. doi:10.1073/pnas.0811205106