Ammoniumfluorid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
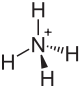 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ammoniumfluorid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | NH4F | ||||||||||||||||||
| Kurzbeschreibung |
weiße, zerfließende Kristalle[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 37,04 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
1 mg·m−3 (einatembarer Aerosolanteil)[2] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Ammoniumfluorid ist das Ammoniumsalz des Fluorwasserstoffs.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Ammoniumfluorid bildet farblose, leicht zerfließende, in Wasser leicht lösliche Kristalle und ist giftig.
Die Substanz ist in der Lage Glas anzugreifen und sollte deshalb bevorzugt in Gefäßen aus Polyethylen (PE), Polyvinylchlorid (PVC) oder in mit Paraffin überzogenen Glasflaschen aufbewahrt werden.[4]
Reaktionen
[Bearbeiten | Quelltext bearbeiten]Beim Erhitzen zerfällt es in Ammoniak und Fluorwasserstoff:
Synthese
[Bearbeiten | Quelltext bearbeiten]Die Darstellung von Ammoniumfluorid erfolgt durch Neutralisation von wässriger Ammoniaklösung mit Flusssäure und anschließender Kristallisation aus Wasser.
Ein anderer Syntheseweg ist das Erhitzen von Ammoniumchlorid mit Natriumfluorid, wobei das Produkt absublimiert:[5]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Ammoniumfluorid dient zum Glasätzen und wird in der Analyse wie Flusssäure zum Aufschließen von Silikaten eingesetzt.[4]
Vorsichtsmaßnahmen
[Bearbeiten | Quelltext bearbeiten]Ammoniumfluorid ist giftig. Berühren mit Haut und Augen vermeiden. Bei Kontakt mit starken Säuren wird Fluorwasserstoff freigesetzt. Dieser ist außerordentlich giftig und stark ätzend.
Entsorgung
[Bearbeiten | Quelltext bearbeiten]Gelöstes Fluorid als Calciumfluorid ausfällen.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu AMMONIUM FLUORIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 12. Februar 2020.
- ↑ a b c d e f g h Eintrag zu Ammoniumfluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ Eintrag zu Ammonium fluoride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b Helmut Hörath: Gefährliche Stoffe und Zubereitungen. 6. Auflage. Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart 2002, ISBN 3-8047-1850-7, S. 410.
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry. 2nd ed., vol. 1, Academic Press 1963, ISBN 012126601X, S. 183.



