Cimetidin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Cimetidin | |||||||||||||||||||||
| Andere Namen |
2-Cyan-1-methyl-3-[2-(5-methylimidazol-4-ylmethylsulfanyl)ethyl]guanidin (IUPAC) | |||||||||||||||||||||
| Summenformel | C10H16N6S | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse |
Magensäureblocker, Immunstimulans | |||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 252,34 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
6,8[2] | |||||||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser (9,38 g·l−1 bei 25 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Cimetidin ist ein Arzneistoff, der als H2-Antihistaminikum zur Dämpfung der Magensaftproduktion eingesetzt wird. Chemisch gehört die Substanz zur Wirkstoffklasse der Guanidin-Derivate.
Entwicklung
[Bearbeiten | Quelltext bearbeiten]Cimetidin ist der erste in die Therapie von Sodbrennen und Magen-Darm-Geschwüren eingeführte H2-Antagonist. Er wurde ab Mitte der 1960er Jahre von SmithKline and French (heute GlaxoSmithKline) entwickelt und kam 1976 als Tagamet auf den Markt.[5][6] Tagamet wurde zu einem der ersten Blockbuster auf dem Pharmamarkt.
Als Entwickler gelten die bei Smith Kline wirkenden britischen Chemiker Graham J. Durant (* 1934), John Colin Emmett (* 1939) und C. Robin Ganellin (* 1934), die dafür in die National Inventors Hall of Fame aufgenommen wurden. Sie arbeiteten dabei mit James Whyte Black zusammen.
Gewinnung und Darstellung
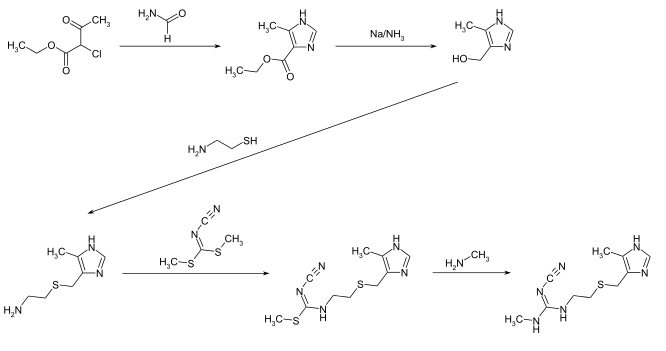
[Bearbeiten | Quelltext bearbeiten]Die Herstellung der Verbindung kann in einer fünfstufigen Synthese erfolgen.[4] Im ersten Schritt wird durch die Umsetzung von 2-Chlor-3-oxobuttersäureethylester mit Formamid das Imidazolstrukturelement gebildet. Die anschließende Reduktion mit Natrium in flüssigem Ammoniak ergibt die Zwischenstufe 4-Hydroxymethyl-5-methylimidazol. Darauf folgen die Umsetzungen mit 2-Aminoethanthiol und Dimethylcyanocarboimidodithionat. Letztere Verbindung kann aus Cyanamid, Schwefelkohlenstoff und Dimethylsulfat in Gegenwart von Kalilauge erhalten werden. Im letzten Syntheseschritt erfolgt mittels Methylamin die Substitution der Methylthiogruppe durch die Methylaminogruppe.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Cimetidin tritt in vier polymorphen Formen und einer Monohydratform auf.[7] Die Schmelzpunkte betragen für das Polymorph A 140,3 °C, für das Polymorph B 142,0 °C und die Polymorphe C und D jeweils 141,9 °C.[1] Die Dehydratisierung des Monohydrates führt zum Polymorph A.[8][9] Die Kristallstrukturen der einzelnen Polymorphen wurde mittels Röntgenbeugung bestimmt.[10][11][12] Die unterschiedlichen Kristallformen unterscheiden sich basierend auf einem unterschiedlichen Löseverhalten in ihrer Bioverfügbarkeit.[13][14][15] In pharmazeutischen Formulierungen werden nur die Formen A und B verwendet.[16]
Pharmakologie
[Bearbeiten | Quelltext bearbeiten]Wirkungsmechanismus
[Bearbeiten | Quelltext bearbeiten]Cimetidin ist ein kompetitiver, reversibler H2-Antagonist der Belegzellen der Magenschleimhaut. Dadurch vermindert es die Sekretion der Magensäure und die Freisetzung des Verdauungsenzyms Pepsin, beeinflusst aber nicht die Bildung des Magenschleims und die Magenentleerung. Zusätzlich wird noch nichtkompetetiv die Vagus- und Gastrin-induzierte Säurefreisetzung unterdrückt.[17]
Darüber hinaus hemmt Cimetidin die H2-Rezeptoren an T-Suppressorzellen und unterbindet deren Wirkung, was zu einer indirekten Immunstimulation führt.[18] Außerdem vermindert es die Sekretion des Parathormons und von Androgenen.
Neuere Leitlinien ziehen allerdings Protonenpumpenhemmer den H2-Blockern in der Therapie der Gastritis, Ösophagitis und der Refluxerkrankungen vor.
Verteilung im Körper
[Bearbeiten | Quelltext bearbeiten]Cimetidin wird oral oder parenteral verabreicht und zu etwa 70 % im Darm resorbiert, vor allem im Ileum. Es verteilt sich in der Blutbahn und gelangt auch in die Milch und passiert die Plazenta. Es wird in der Leber verstoffwechselt, zum Teil auch unverändert über den Urin ausgeschieden. Die Halbwertszeit beträgt etwa eine Stunde.
Anwendungsgebiete
[Bearbeiten | Quelltext bearbeiten]- Ulzera im Magen, Labmagen und Duodenum
- Akute Pankreatitis und exokrine Pankreasinsuffizienz
- Gastritis
- Ösophagitis und gastroösophagealer Reflux
- Duodenal-gastrischer Reflux
- Blutungen im oberen Magen-Darm-Trakt
- Gastrinome und systemische Mastozytose
- Immunstimulation, Einsatz z. B. bei Melanomen beim Pferd
Kontraindikationen und Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]Bei Überempfindlichkeit und schweren Nieren- oder Lebererkrankungen ist die Anwendung kontraindiziert. Die Anwendung bei lebensmittelliefernden Tieren ist nicht erlaubt.
Beim Menschen wurden geistige Verwirrung, Kopfschmerzen, Gynäkomastie, verminderte Libido, kardiale Arrhythmien (Bradykardie) und selten auch eine Agranulozytose beobachtet. Zudem hat es eine hohe Delirium-induzierende Potenz.[19][20][21] In der Tiermedizin gibt es keine Berichte von Nebenwirkungen.
Wechselwirkungen
[Bearbeiten | Quelltext bearbeiten]Da Cimetidin einen hemmenden Einfluss auf einige Cytochrom-P450-Enzyme hat, sind durch Wirkverlängerung- und -verstärkung zahlreiche Interaktionen möglich und kann somit zu einer Inkompatibilität mit Arzneistoffen führen, die als Enzym-Induktoren an CYP-450-Enzymen wirken, oder von selbigen abgebaut werden.[17] Dies ist auch ein Grund dafür, warum Cimetidin nicht im rezeptfreien OTC-Verkauf zur Verfügung steht, im Vergleich zu den anderen H2-Blockern, wie Ranitidin und Famotidin. Ferner ist Cimetidin deswegen nicht mehr Therapieempfehlung der ersten Wahl, da mit Ranitidin (und mit Protonenpumpenhemmern) bezüglich der Magensäurehemmung ein länger und stärker wirksamer Arzneistoff mit besserer Verträglichkeit zur Verfügung steht.[22]
Cimetidin hemmt die Kreatininsekretion in den Nieren und kann deshalb laborchemisch eine erniedrigte Glomeruläre Filtrationsrate vortäuschen.[23] Die Ursache hierfür ist im Wesentlichen, dass Cimetidin den Efflux aus den proximalen Tubuluszellen über die beiden SLC-Transporter MATE1 (SLC47A1, multidrug and toxin extrusion 1) und MATE2-K (SLC47A2, multidrug and toxin extrusion 2 - kidney)[24] an der apikalen Seite inhibiert.[25] Darüber hinaus inhibiert Cimetidin – allerdings etwas schwächer als MATE1 und MATE2-K – auch den organischen Kationentransporter 2 (OCT2) an der basolateralen Seite.[26]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Cimetag (A), CimLich (D), H 2 Blocker (D), Neutromed (A), Ulcostad (A) und weitere Generika (D, A)[27][28][29]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Eintrag zu Cimetidin bei Vetpharm, abgerufen am 11. August 2012.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Calvo, N.L.; Maggio, R.M.; Kaufman, T.S.: A dynamic thermal ATR-FTIR/chemometric approach to the analysis of polymorphic interconversions. Cimetidine as a model drug In: J Pharm Biomed Anal. 92 (2014) 90-97, doi:10.1016/j.jpba.2013.12.036
- ↑ a b Eintrag zu Cimetidine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b Datenblatt Cimetidine bei Sigma-Aldrich, abgerufen am 23. März 2011 (PDF).
- ↑ a b c d e f g A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances - Synthesis, Patents, Applications, 4. Auflage (2000), Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9.
- ↑ a b c d e f g Eintrag zu Cimetidin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Juli 2014.
- ↑ Die Geschichte von GSK. glaxosmithkline.de, abgerufen am 5. Juli 2012.
- ↑ K. Harsányi, G. Domány, L. Toldy: Cimetidine monohydrate and processes for its preparation and use, Patent GB 2101991, June 24, 1982.
- ↑ M. Shibata, H. Kokubo, K. Morimoto, K. Morisaka, T. Ishida, M. Inoue: X-ray structural studies and physicochemical properties of cimetidine polymorphism. In: J Pharm Sci. 72 (1983) 1436–1442, doi:10.1002/jps.2600721217.
- ↑ D.A. Middleton, C.S.L. Duff, X. Peng, D.G. Reid, D. Saunders: Molecular conformations of the polymorphic forms of cimetidine from 13C solid-state NMR distance and angle measurements. In: J. Am. Chem. Soc. 122 (2000) 1161–1170, doi:10.1021/ja993067z.
- ↑ E. Hadicke, F. Frickel, A. Franke: Die Struktur von Cimetidin (N-Cyan-N-Methyl-N'-[2-[[(5-methyl-1H-imidazol-4-yl)methyl]thio]ethyl]guanidin), einem Histamin H2-Rezeptor-Antagonist. In Chem. Ber. 111 (1978) 3222–3232, doi:10.1002/cber.19781110926.
- ↑ L. Párkányi, A. Kálmán, B. Hegedüs, K. Harsanyi, J. Kreidl: Structure of a novel and reproducible polymorph (Z) of the histamine H2-receptor antagonist cimetidine, C10H16N6S. In: Acta Cryst. C40 (1984) 676–679.
- ↑ A. Arakcheeva, P. Pattison, A. Bauer-Brandl, H. Birkedal, G. Chapuis: Cimetidine C10H16N6S, form C: crystal structure and modelling of polytypes using the superspace approach. In: J. Appl. Cryst. 46 (2013) 99–107.
- ↑ H. Kokubo, K. Morimoto, T. Ishida, M. Inoue, K. Morisaka: Bioavailability and inhibitory effect for stress ulcer of cimetidine polymorphs in rats. In: Int J Pharm. 35 (1987) 181–183, doi:10.1016/0378-5173(87)90088-3.
- ↑ T. Funaki, S. Furata, N. Kaneniwa: Discontinuous absorption property of cimetidine. In: Int J Pharm. 31 (1986) 119–123, doi:10.1016/0378-5173(86)90220-6.
- ↑ H. Kamiya, K. Morimoto, K. Morisaka: Dissolution behavior and bioavailability of cimetidine–HCl (cimetidine monohydrochloride monohydrate). In: Int J Pharm. 26 (1985) 197–200, doi:10.1016/0378-5173(85)90212-1.
- ↑ G.H.W. Sanders, C.J.R. Roberts, A. Danesh, A.J. Murray, D.M. Price, M.C. Davies, S.J.B. Tendler, M.J. Wilkins: Discrimination of polymorphic forms of a drug product by localised thermal analysis. In: J. Microsc. 198 (2000) 77–81, doi:10.1046/j.1365-2818.2000.00709.x.
- ↑ a b Mutschler, Geisslinger, Kroemer, Ruth, Schäfer-Korting, Mutschler Arzneimittelwirkungen, 9. Auflage, 2008, ISBN 3-8047-1952-X.
- ↑ Schmidmaier R.: Beeinflussung der Regulatorfunktion mononukleärer Zellen des peripheren Blutes (PBMC) in vitro. Dissertation, München 2001. Abgerufen am 1. November 2012. (PDF).
- ↑ C. Gordon: Differential diagnosis of cimetidine-induced delirium. In: Psychosomatics. Band 22, Nummer 3, März 1981, S. 251–252, doi:10.1016/S0033-3182(81)73536-9. PMID 7220787.
- ↑ W. W. Weddington, A. E. Muelling u. a.: Cimetidine toxic reactions masquerading as delirium tremens. In: JAMA. Band 245, Nummer 10, März 1981, S. 1058–1059, PMID 7463626.
- ↑ A. Strauss: Cimetidine and delirium: assessment and management. In: Psychosomatics. Band 23, Nummer 1, Januar 1982, S. 57–62, doi:10.1016/S0033-3182(82)70811-4. PMID 7058250.
- ↑ Ruß, Endres, Arzneimittelpocket Plus 2008, 4. Auflage Okt. 2007, ISBN 978-3-89862-287-5.
- ↑ Lesley A. Stevens, Shani Shastri, Andrew S. Levery: Assessment of Renal Function in Jürgen Floege, Richard J Johnson, John Feehally : Comprehensive Clinical Nephrology, 4. Auflage, St. Louis, 2010 S. 32f.
- ↑ Michael Freissmuth: Pharmakokinetik. In: Michael Freissmuth, Stefan Offermanns, Stefan Böhm: Pharmakologie und Toxikologie. Springer, 2012, ISBN 3-642-12353-8, S. 27. eingeschränkte Vorschau in der Google-Buchsuche.
- ↑ S. Ito, H. Kusuhara u. a.: Competitive inhibition of the luminal efflux by multidrug and toxin extrusions, but not basolateral uptake by organic cation transporter 2, is the likely mechanism underlying the pharmacokinetic drug-drug interactions caused by cimetidine in the kidney. In: Journal of Pharmacology and Experimental Therapeutics. Band 340, Nummer 2, Februar 2012, S. 393–403, doi:10.1124/jpet.111.184986. PMID 22072731.
- ↑ H. Ehrsson, I. Wallin u. a.: Cimetidine as an organic cation transporter antagonist. In: The American Journal of Pathology. Band 177, Nummer 3, September 2010, S. 1573–1574, doi:10.2353/ajpath.2010.100484. PMID 20651231. PMC 2928986 (freier Volltext).
- ↑ Rote Liste, 08/2009.
- ↑ AM-Komp. d. Schweiz, 08/2009.
- ↑ AGES-PharmMed, 08/2009.