Kohlenstoffkette



Der Begriff der Kohlenstoffkette bezeichnet in der organischen Chemie ein Strukturelement von Verbindungen, bei denen mehrere Kohlenstoff-Kohlenstoff-Bindungen auftreten, also die Kohlenstoffatome miteinander verkettet sind. Unterschieden werden lineare und verzweigte Ketten. Die Kohlenstoffatome erhalten unterschiedliche Bezeichnungen je nach Lage in der Kette: Ein primäres Kohlenstoffatom hat nur ein weiteres Kohlenstoffatom als Nachbarn, ein sekundäres Kohlenstoffatom zwei, ein tertiäres Kohlenstoffatom drei und ein quartäres Kohlenstoffatom vier.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Zur Darstellung von Kohlenstoffketten gibt es unterschiedliche Möglichkeiten. In Valenzstrichformeln werden alle an der Kette gebundenen Atome eingezeichnet. Oft werden die mit der Kohlenstoffkette verknüpften Wasserstoffatome weggelassen und nur die C-C-Bindungen dargestellt; diese Schreibweise wird Skelettformel genannt.
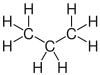
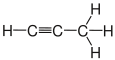
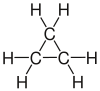
Die Kohlenstoffatome können über kovalente Einfachbindungen verkettet sein, wie beispielsweise in den Alkanen. Dabei sind die Moleküle um die Achse dieser Bindung frei drehbar. Sind zwei Kohlenstoffatome über eine Doppelbindung verknüpft, wie bei den Alkenen, ist die freie Drehbarkeit dieser Bindung aufgehoben. Bei Alkinen sind zwei Kohlenstoffatome durch eine Dreifachbindung verbunden. Ein Sonderfall sind ringförmige Verbindungen wie z. B. Cycloalkane: Hier ist die Kohlenstoffkette geschlossen. Es existieren verschiedene ringförmige Verbindungen, die aus unterschiedlich vielen Kohlenstoffatomen aufgebaut sind. Die Drehbarkeit der Bindungen ist bei kleinen Ringen stark eingeschränkt, nimmt aber mit steigender Ringgröße zu.
| Propan | Propen | Propin | Cyclopropan |
|---|---|---|---|
|

|
|
|
Auch Polymere können als Strukturelement Kohlenstoffketten aufweisen. Polyethylen und Polypropylen beispielsweise bestehen ausschließlich aus langkettigen Kohlenwasserstoffmolekülen. Die Eigenschaften der Polymere sind von der Länge der Kohlenstoffkette, deren Aufbau (Regelmäßigkeit, Verzweigungen) sowie von den eingesetzten Copolymeren oder Additiven abhängig.
Zwischen den unpolaren Kohlenstoffketten wirken Van-der-Waals-Kräfte, d. h. induzierte Dipole führen zur Ausbildung von schwachen Bindungen zwischen den einzelnen Molekülen, den Van-der-Waals-Bindungen. Anschaulich zeigt sich dies bei den Alkanen, deren Siedepunkt mit der Kettenlänge steigt.
Bedeutung für die Nomenklatur von organischen Verbindungen
[Bearbeiten | Quelltext bearbeiten]In der systematischen Namensgebung (IUPAC-Nomenklatur) von organisch-chemischen Vierbindungen spielt die Ermittlung der längsten Kohlenstoffkette (offenkettig oder ringförmig) eine wichtige Rolle. Der Stammname einer solchen Verbindung leitet sich vom Namen der längsten Kohlenstoffkette im Molekül ab, der dann ggf. durch Präfixi, Suffixe, Affixe usw. präzisiert wird.[1]
Weitere Elemente, die kettenförmige Verbindungen ausbilden können:
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 24–27, ISBN 3-342-00280-8.